多伦多大学的科学家们已经成功地测试了使用机器学习模型来指导长效注射药物配方的设计。机器学习算法加速药物配制的潜力可以减少与药物开发相关的时间和成本,从而更快地提供有前途的新药。
该研究今天发表在Nature Communications上,是首批将机器学习技术应用于聚合物长效可注射药物制剂设计的研究之一。
这项多学科研究由多伦多大学药学系的 Christine Allen和化学与计算机科学系的 Alán Aspuru-Guzik 领导。两位研究人员也是 Acceleration Consortium 的成员,Acceleration Consortium 是一项全球倡议,利用人工智能和自动化来加速发现可持续未来所需的材料和分子。
“这项研究朝着数据驱动的药物制剂开发迈出了关键一步,重点是长效注射剂,”多伦多大学 Leslie Dan 药学院药物科学教授 Christine Allen 说。“我们已经看到机器学习如何在发现有可能成为药物的新分子方面取得令人难以置信的飞跃式进步。我们现在正在努力应用相同的技术来帮助我们设计更好的药物配方,并最终更好地药物。”
长效注射剂 (LAI) 被认为是治疗慢性病最有希望的治疗策略之一,是一类先进的药物输送系统,旨在长时间释放其货物以实现长期治疗效果。这种方法可以帮助患者更好地坚持他们的药物治疗方案,减少副作用,并在靠近身体作用部位注射时提高疗效。然而,要在所需的时间内实现最佳的药物释放量,需要通过广泛且耗时的实验来开发和表征各种候选制剂。与更传统类型的药物制剂相比,这种反复试验的方法在 LAI 开发中造成了重大瓶颈。
“人工智能正在改变我们从事科学研究的方式。它有助于加速发现和优化。这是‘人工智能之前’和‘人工智能之后’时刻的完美例子,展示了这种多学科研究如何影响药物输送,”说Alán Aspuru-Guzik,多伦多大学化学和计算机科学教授,同时担任多伦多 Vector Institute 的 CIFAR 人工智能研究。
为了研究机器学习工具是否能够准确预测药物释放速率,研究团队训练并评估了一系列 11 种不同的模型,包括多元线性回归 (MLR)、随机森林 (RF)、光梯度增强机 (lightGBM)、和神经网络 (NN)。用于训练选定的机器学习模型组的数据集是根据作者和其他研究小组之前发表的研究构建的。
“一旦我们有了数据集,我们就把它分成两个子集:一个用于训练模型,一个用于测试。然后我们让模型预测测试集的结果,并直接与之前的实验数据进行比较。我们发现基于树的模型,特别是 lightGBM,提供了最准确的预测,”多伦多大学 Leslie Dan 药学院 Allen 研究小组的助理研究员 Pauric Bannigan 说。
下一步,该团队致力于应用这些预测并说明机器学习模型如何用于为新 LAI 的设计提供信息,该团队使用先进的分析技术从 lightGBM模型中提取设计标准. 这允许为目前用于治疗卵巢癌的药物设计新的 LAI 配方。Bannigan 说:“一旦你有了训练有素的模型,你就可以解释机器学到了什么,并用它来制定新系统的设计标准。” 准备好后,将测试药物释放速率,并进一步验证 lightGBM 模型所做的预测。“果然,该配方具有我们正在寻找的缓慢释放速率。这很重要,因为在过去,我们可能需要多次迭代才能获得看起来像这样的释放配置文件,而通过机器学习,我们可以做到这一点一个,”他说。
当前研究的结果令人鼓舞,并表明机器学习有可能减少对试错测试的依赖,从而减缓长效注射剂的开发速度。然而,该研究的作者指出,制药科学中缺乏可用的开源数据集对未来的进步构成了重大挑战。“当我们开始这个项目时,我们对使用聚合物微粒的大量研究报告缺乏数据感到惊讶,”艾伦说。“这意味着无法利用研究和相关工作来开发我们推动该领域进步所需的机器学习模型,”艾伦说。“确实需要在开放存取的制药科学领域创建强大的数据库并且可供所有人使用,以便我们可以共同努力推进该领域,”她说。
为了促进向支持机器学习更广泛地整合到制药科学中所需的可访问数据库的转变,艾伦和研究团队已经在开源平台 Zenodo 上提供了他们的数据集和代码。
“对于这项研究,我们的目标是降低将机器学习应用于制药科学的准入门槛,”Bannigan 说。“我们已经使我们的数据集完全可用,因此其他人可以希望在这项工作的基础上再接再厉。我们希望这是药物配方 中机器学习故事的开始,而不是结束。”
智能推荐
-
科学家们拍下艾滋病内部,无法治愈(有望研发药物)2023-08-15 人类免疫弊端病毒(HIV)是一种核糖核酸(RNA)病毒。RNA是HIV和流感等病毒的基本。这些病毒没有DNA,合座凭借RNA来照顾和践诺应许病毒入侵和降服宿主细胞
-

北濑佳范:《最终幻想7:重生》开发工作快速推进中2023-08-17 《最终幻想7:重生》的开发工作正在快捷促进中,游戏制作人揭示将在223年发表大新闻。《最终幻想7:重生》制作人北濑佳范在新年贺词中透露表现,本作开发工作正在快捷促
-

特殊使用级抗菌药物的使用流程(特殊使用级抗菌药物)2023-08-24 大家好,我是小跳,我来为大家解答以上问题。特殊使用级抗菌药物的使用流程,特殊使用级抗菌药物很多人还不知道,现在让我们一起来看看吧
-

科学家开发新方法来增强药物递送以治疗儿童脑肿瘤2023-08-01 西奈山卫生系统和纪念斯隆凯特琳癌症中心的研究人员开发了一种新型药物递送方法,该方法使用纳米颗粒实现更有效和有针对性的抗癌药物递送,以治疗儿童脑肿瘤
-

NUST MISIS科学家开发了隐形技术2023-07-22 NUSTMISIS的物理学家,以及都灵理工大学(意大利)和俄罗斯科学院独特仪器科学技术中心(STCUIRAS)的同事们,都拥有一项技术使各种细长NUSTMISIS
-

快速学会催眠术教程(快速学习催眠术)2023-09-26 大家好,小范来为大家解答以上的问题。快速学会催眠术教程,快速学习催眠术这个很多人还不知道,现在让我们一起来看看吧
-
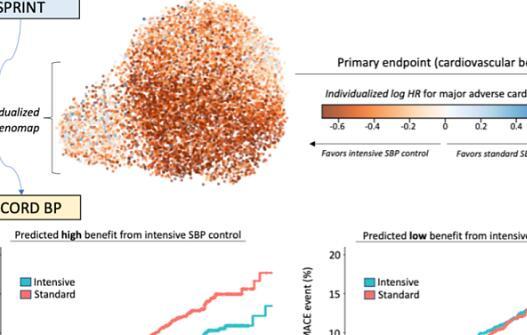
机器学习引导的个性化血压管理方法2023-08-25 高血压是持续血压高于14/9毫米汞柱,是全球心脏病、残疾和过早死亡的主要原因之一。然而,应降低血压以改善这种风险的水平一直存在争议,特别是对于2型糖尿病患者,其积
-

科学家使用激光重建扭曲超导材料2023-08-30 芝加哥大学和山西大学的科学家宣布,他们已经创造了一种使用激光来“模拟”一种材料的方法,物理学家多年来一直对其潜在的技术应用垂涎三尺
-

由于机器学习癌症的血液测试显示出希望2023-08-04 威斯康星大学麦迪逊分校的一组研究人员成功地将基因组学与机器学习相结合,以开发可及的测试,以便早期发现癌症
-

科学家开发石墨烯气凝胶颗粒用于高效水净化2023-07-31 在《分子液体杂志》上,由国家石墨烯研究所(NGI)的AravindVijayaraghavan教授领导的团队利用涡旋环效应的变化,生产了由石墨烯制成的三维颗粒,具
-

易语言快速写挂(如何使用易语言写挂)2023-08-28 大家好,我是小小根,我来为大家解答以上问题。易语言快速写挂,如何使用易语言写挂很多人还不知道,现在让我们一起来看看吧
-
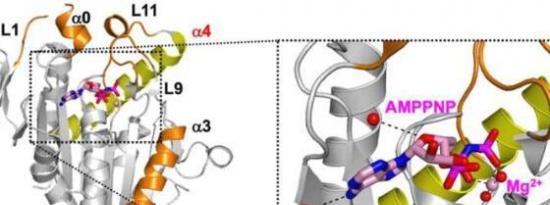
副作用较少的抗癌药物:科学家解码关键细胞周期蛋白的晶体结构2023-08-27 抗癌药物对癌症治疗至关重要,但它们的毒性可能并不总是局限于癌细胞,从而导致有害的副作用。为了开发对患者不利影响较小的抗癌疗法,科学家们现在专注于对细胞毒性较小的分
