阿尔茨海默氏症和帕金森氏症等神经退行性疾病是由于突变蛋白的异常积累导致特定类型的神经元丢失所致。尽管已发现特定大脑区域在这些疾病中特别脆弱,但大脑细胞和区域对有毒突变蛋白的这种不同脆弱性背后的原因和确切机制尚不清楚。
贝勒医学院杰出服务教授、德克萨斯儿童医院 Jan 和 Dan Duncan 神经病学研究所 (Duncan NRI) 的创始主任 Huda Zoghbi 博士实验室最近的一项研究在脊髓小脑性共济失调的背景下解决了这个问题1 型 (SCA 1),并揭示了导致这种神经退行性疾病的分子参与者和途径的多样性。
这一发现发表在Neuron上,为更好地了解其他神经退行性疾病的区域脆弱性绘制了一条调查路径。
SCA1 是一种进行性神经退行性疾病,影响全球约 100,000 人中的一到两人,主要特征是运动协调和平衡丧失。它是由突变体 ATXN1 蛋白的存在引起的,该蛋白具有称为聚谷氨酰胺 (polyQ) 重复的长不间断延伸。
在健康的神经元中,ATXN1 与 capicua (CIC) 相互作用,capicua 是一种抑制多个基因表达的蛋白质。另一方面,当突变体 ATXN1 与 CIC 结合时,CIC 靶基因过度表达,最终对神经元产生毒性。先前的研究表明,SCA1 小鼠模型中小脑浦肯野细胞的所有变化都是由 ATXN1-CIC 复合体活性增强引起的。
然而,ATXN1 蛋白广泛表达并在大脑的各个区域发挥作用。
“令人惊讶的是,一个关键问题仍未得到探索,即 CIC 是否在其他大脑区域驱动 ATXN1 的毒性,或者其他分子参与者是否在其他受影响的神经元中驱动毒性,”Zoghbi 说,他也是霍华德休斯医学研究所的研究员。
为了解决这个问题,Zoghbi 实验室的研究生 Stephanie Coffin 创建了一个新的 SCA1小鼠模型来模拟人类 ATXN1 突变及其对整个大脑的影响。在这个模型中,ATXN1 基因具有扩展的聚谷氨酰胺延伸,但她还突变了对 ATXN1-CIC 相互作用至关重要的两个氨基酸。
Zoghbi 团队发现这两个突变完全消除了所有大脑区域的 ATXN1-CIC 相互作用。
“ATXN1-CIC 复合体的破坏导致 SCA1神经系统症状的部分改善,如运动不协调、呼吸和寿命短,并且只使基因表达变化的一部分恢复正常,”Coffin 说。
“总之,这些发现为我们提供了一条线索,即 CIC 可能不是驱动 SCA1 的唯一 ATXN1 相互作用因子,而且其他分子参与者可能有助于 SCA1 患者和动物模型中出现的各种神经系统症状的发展和进展。”
为了识别 ATXN1 的其他相互作用因子,他们使用免疫沉淀和质谱法进行了无偏蛋白质组学筛选。
“鉴于转录变化是 SCA1 的标志,我们专注于在人类和小鼠大脑的不同区域表达的三种转录因子,称为 ZKSCAN1、ZBTB5 和 RFX1,”Coffin 补充说,他目前是 Pelagos 的神经科学项目经理医药。
“我们验证了 ATXN1 与这些新发现的合作伙伴之间的相互作用,并发现受 RFX1 和 ZKSCAN1 调控的基因表达在 SCA1 小鼠和人类神经元中发生了改变。此外,这两个新发现的合作伙伴——RFX1 和 ZKSCAN1——与 CIC 一起是预计会调节大约 33% 的基因,这些基因在 SCA1 小鼠模型中的表达发生了改变,突出了它们在这种疾病的发病机制中发挥的重要作用。”
“我们非常惊讶地发现,对于这种单基因疾病,突变蛋白使用不同的伙伴来驱动不同脑细胞的毒性,”Zoghbi 说。“事实上,这项研究强调了调查其他疾病驱动蛋白的伙伴的重要性,不仅对于其他多聚谷氨酰胺疾病,而且广泛地,对于所有神经退行性疾病。只有通过这样的系统研究,我们才能了解驱动这些疾病的机制和能够更好地探索治疗干预措施。”
智能推荐
-
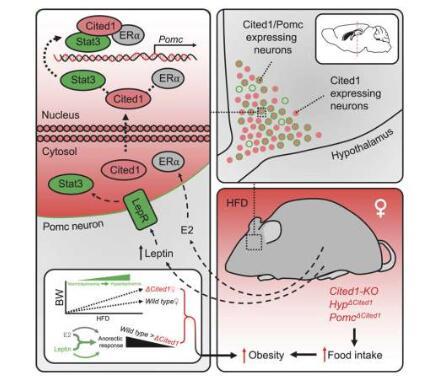
新型蛋白质将性和代谢激素联系起来 以防止肥胖2023-08-04 在能量稳态的调节中存在性别差异。例如,目前的研究表明,包括人类在内的雌性哺乳动物在育龄期可以更好地预防代谢疾病
-

《OW2》迎首席关卡设计师 曾参与多部《COD》开发2023-08-07 《OW2》迎首席关卡设计师 曾参与多部《COD》开发,cod,ow2,关卡,设计师,育碧
-

开发商343i为肢体残缺儿童提供《光环》主题义肢2023-08-25 《光环:无限》游戏开发商343Industries即日示意,将与义肢出产公司LimbitlessSolutions持续扩张合营伙伴关联,以供给更多以《光环》为焦点
-

msds是什么意思可以提供什么信息(msds是什么意思)2023-08-22 msds的全称是materialsafetydatasheet,意为“化学品安然身手仿单。”它是化学品分娩、商业、发卖企业按功令请求向下旅客户供给的相关化学品特点
-
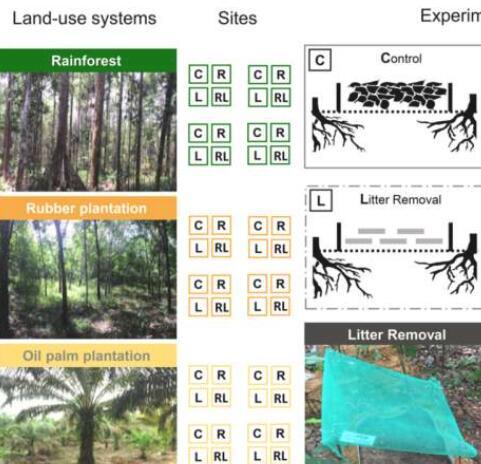
研究揭示植物根系为热带土壤动物群落提供燃料2023-08-01 热带地区的土壤动物群落是由植物根系和从中衍生的资源驱动的。这是由哥廷根大学,德国综合生物多样性研究中心(iDiv)和莱比锡大学领导的研究小组的一项新研究的主要发现
-

山东商户蒸1万个大馒头驰援河北!没有救援设备但有一颗为受灾同胞提供温饱的真心2023-08-24 大家好,大家对山东商户蒸1万个大馒头驰援河北!没有救援设备但有一颗为受灾同胞提供温饱的真心很关注,下面小雪整理下相关的信息,现在让我们一起来看看吧
-
非法提供麻醉药品罪既遂一般要怎么判刑2023-08-23 1、犯非法提供麻醉药品罪的,处三年以下有期徒刑或者拘役,并处罚金;2、若是情节严重的,则处三年以上七年以下有期徒刑,并处罚金;3、向走私、贩卖毒品的犯罪分子或者以牟利为目的,向吸食、注射毒品的人提供国
-
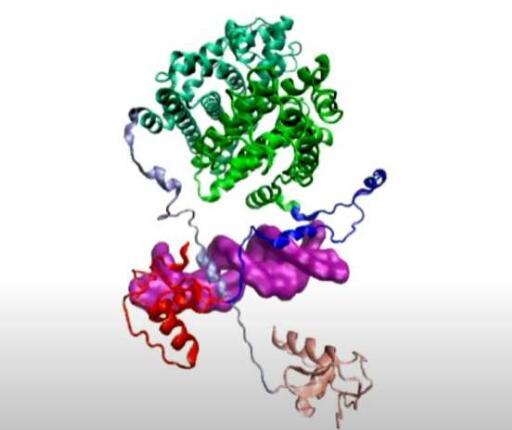
研究人员揭示了对乳腺癌至关重要的蛋白质背后的动态2023-08-06 根据莱斯大学的科学家的说法,观看木偶戏可以教你一些关于雌激素如何在体内起作用的知识,他们的研究可以为调节激素的新策略打开大门-这可能有助于预防乳腺癌和其他疾病
-
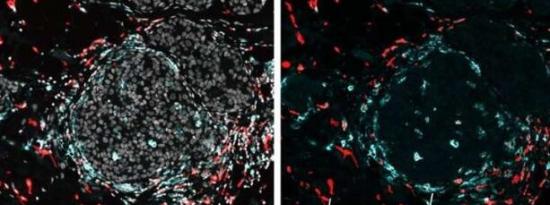
新方法精确定位跨组织的基因活性和蛋白质2023-08-05 根据威尔康奈尔医学院、纽约长老会和纽约基因组中心的研究人员共同领导的一项研究,一种新方法可以以前所未有的分辨率阐明整个器官或肿瘤中细胞的身份和活动
-

光遇挚友日任务怎么参与 挚友日任务参与方法介绍2023-08-06 ,')光遇中的至好日任务活动是双十一打开的一项精灵任务,网友能够在游戏中经过精灵查看任务关联的内容,那么具体怎样插手活动呢,接下来的小编就给网友带来了光遇至好日任
-
蛋白质伙伴关系有效抵御胰腺癌进展2023-08-04 VCUMassey癌症中心的科学家发现了两组蛋白质之间以前未被认识到的关系,这些蛋白质协同工作以抵御胰腺癌的生长
-

发现骨关节炎背后的新机制可以为新疗法提供信息2023-07-30 美国和的研究人员发现了一种新机制,将与年龄相关的软骨组织硬化与抑制一种与长寿相关的关键蛋白质联系起来
